Hóa học là một trong những môn học vô cùng quan trọng, nó không chỉ được áp dụng vào những bài thi mà nó còn được áp dụng nhiều vào cuộc sống thực tiễn. Sẽ có nhiều kiến thức môn Hóa Học mà bạn học sinh nào cũng cần biết, nhưng có một số nội dung đang là vấn đề thắc mắc nhiều trên những diễn đàn là “công thức liên hệ giữa nồng độ mol và nồng độ phần trăm”. Nồng độ mol thì không còn xa lạ gì đối với mỗi em học sinh, nhưng công thức liên hệ này có nhiều em không nhớ, và gặp khó khăn. Hãy cùng Top Nổi Bật tìm hiểu về khái niệm, công thức và một số bài tập áp dụng qua bài viết dưới đây nhé.
Xem thêm:
- Công thức Hidroxit cao nhất của lưu huỳnh có ví dụ minh họa
- Công thức tính nồng độ mol, nồng độ phần trăm dung dịch và bài tập
- Công thức tính phần trăm thể tích và bài tập có lời giải dễ hiểu
- Công thức tính m chất tan và bài tập có lời giải dễ hiểu
Tìm hiểu về nồng độ mol
- Nồng độ mol là biểu thị số mol của một chất tan có trong dung dịch
- Kí hiệu của nồng độ mol là: M hay mol
- Nồng độ mol được áp dụng rộng rãi trong hóa học để thể hiện lượng chất phản ứng và sản phẩm của những phản ứng hóa học. Bên cạnh đó, nồng độ mol còn được áp dụng để thể hiện số lượng nguyên tử và các thực thế khác nhau trong một mẫu nhất định của chất hoặc ion.
- Công thức tính nồng độ mol là:
CM = n/Vdd
Trong đó có CM là nồng độ mol
n là số mol chất tan
Vdd là thể tích của dung dịch (L)

Tìm hiểu về nồng độ phần trăm
- Trong kiến thức môn Hóa Học, nồng độ phần trăm của dung dịch giúp ta biết được số gam chất tan có trong 100g dung dịch là bao nhiêu.
- Kí hiệu của nồng độ phần trăm là C%
- Công thức tính nồng độ phần trăm là:
C% = (mct/mdd).100%
Trong đó có C% là nồng độ phần trăm
mct là khối lượng của chất tan
mdd là khối lượng của dung dịch

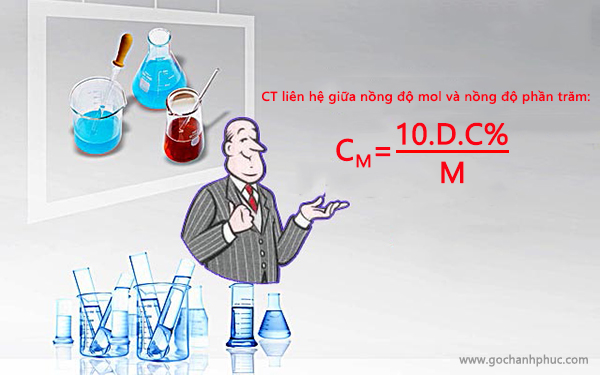
Công thức liên hệ giữa nồng độ mol và nồng độ phần trăm
Công thức liên hệ giữa nồng độ mol và nồng độ phần trăm là:
CM = (10.D.C%)/M
Trong đó có C% là nồng độ phần trăm (%)
CM là nồng độ mol/lit (M/L)
M là khối lượng của mol chất (g)
D là khối lượng riêng của dung dịch (g/ml)
Ví dụ minh họa: Tính nồng độ mol biết rằng dung dịch HCl 45%, d = 1,28
Lời giải
Áp dụng công thức ta có:
CM = (10.1,28.45)/36,5 = 15,7
Hy vọng bì viết trên sẽ giúp bạn đọc dễ hiểu, dễ nhớ công thức và dễ áp dụng vào bài tập nhé. Hãy học tập thật chăm chỉ, thường xuyên luyện tập nhiều dạng bài tập khác nhau nhé. Chúc các em học sinh có một ngày học tập thật vui vẻ, đáng nhớ nhé.