Công thức hidroxit cao nhất của lưu huỳnh là gì? Đây là một trong những câu hỏi đang được những bạn học sinh quan tâm nhiều nhất, khi học về Hóa Học chắc hẳn các bạn đều đã nghe đến hidroxit, nhưng lại không biết được công thức cao nhất của lưu huỳnh. Bài viết này Top Nổi Bật sẽ chia sẻ chi tiết cho bạn đọc những thông tin cần thiết.
Xem thêm:
- Công thức liên hệ giữa nồng độ mol và nồng độ phần trăm, ví dụ minh họa
- Công thức oxit cao nhất của lưu huỳnh và bài tập có đáp án
Kiến thức về Hidroxit
- Trong kiến thức môn Hóa Học, Hidroxit có tên gọi khác là anion nhị nguyên tử OH–, nó bao gồm một nguyên tử oxy kết hợp với một nguyên tử hidro, thông thường nó sẽ phát sinh ra từ sự điện li của một bazo. Ngoài ra, nó cũng chính là một trong những ion hai nguyên tử đơn giản nhất đã biết.
- Những hợp chất vô cơ chứa nhóm hidroxy có tên gọi chung là hidroxit.
- Hầu như những hợp chất chứa hidroxit đều thể hiện tính chất của một bazo. Một bazo Arrhenius chính là một chất có thể sinh ra những ion hidroxit khi hòa tan dung dịch với nước. (Ví dụ: amoniac, NH3)
- Những ion hidroxit khi tham gia một cách mạnh mẽ trong những phản ứng trung hòa (giữa axit và bazo)

Kiến thức về lưu huỳnh
Như bạn đã biết, lưu huỳnh chính là một phi kim rất phổ biến hiện nay, nó có những đặc điểm nổi trội như sau:
- Không mùi, không vị và có nhiều hóa trị
- Lưu huỳnh khi ở dạng gốc là một chất rắn được kết tinh màu vàng chanh
- Trong tự nhiên, bạn có thể dễ dàng thấy lưu hình ở dạng đơn chất hoặc trong những khoáng chất sulfua, sulfat. Lúc này nó có mùi vị giống với mùi trứng ung, đây chính là mùi vị đặc trưng của sulfua hidro (H2S)
- Hiện nay lưu huỳnh được sử dụng nhiều trong những loại phân bón hoặc trong thuốc súng, diêm, thuốc trừ sâu…
- Lưu huỳnh chính là chất được ứng dụng nhiều vào cuộc sống thực tế như trong công nghiệp, nông nghiệp, làm đẹp…
- Những ảnh hưởng tiêu cực của lưu huỳnh đối với những sinh vật dưới nước, ảnh hưởng đến sức khỏe, gây ô nhiễm môi trường…

Công thức hidroxit cao nhất của lưu huỳnh
Công thức hidroxit cao nhất của lưu huỳnh là H2SO4

Ví dụ minh họa: Nguyên tố X thuộc nhóm XIA trong bảng tuần hoàn, phần trăm khối lượng của X trong oxit cao nhất chính là 40%. Gọi Y là hidroxit cao nhất của X. Hãy viết công thức cấu tạo của Y (thỏa mãn với quy tắc bát tử) và viết phương trình phản ứng của Y với K2CO3; BaCl2?
Lời giải
Công thức hidroxit cao nhất của S chính là: S(OH)6, khi bớt 2 H2O ta sẽ thu được H2SO4.
Ta có công thức cấu tạo H2SO4 là:
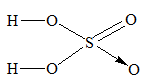
Phương trình hóa học là:
- H2SO4 + K2CO3 ⇒ K2SO4 + H2) + CO2
- H2SO4 + BaCl2 ⇒ BaSO4 + 2HCl
Bài viết trên Top Nổi Bật đã cung cấp cho bạn đọc kiến thức về hidroxit, lưu huỳnh và công thức hóa học của lưu huỳnh đioxit. Nếu như còn thắc mắc điều gì hãy để lại bình luận bên dưới nhé.