Chắc hẳn nhiều người đã nghe tới rượu và một vài công dụng của rượu. Tuy nhiên, công thức hoá học của rượu là gì? và rượu có những đặc điểm gì thì hôm nay Top Nổi Bật sẽ giải đáp cho bạn.
Xem thêm:
- Công thức hóa học của Axit Sunfuric kèm ví dụ minh họa
- [Đáp án] Công thức hoá học của sắt 3 oxit là gì? Giải bài tập thường gặp
- Công thức Axit Glutamic và bài tập minh họa dễ hiểu
Rượu là gì?
Trong hoá học, rượu là một hợp chất hữu cơ, có chứa nhóm -OH gắn vào một nguyên tử cacbon, tên gọi hoá học của nó là Etanol hay rượu Etylic.
Trong đời sống, rượu được hiểu là một loại đồ uống có cồn.
Các công thức hoá học của rượu
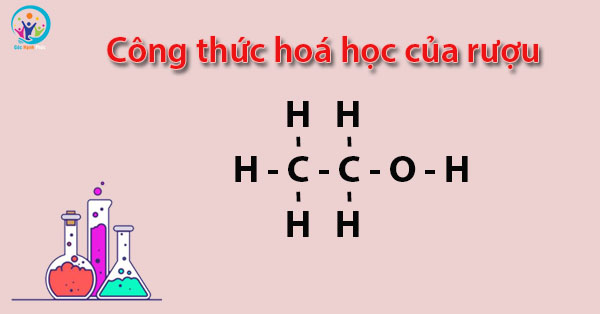
Công thức hoá học của rượu là C2H6O hoặc C2H5OH.
Với công thức C2H6O:
CH3 – CH2 – OH
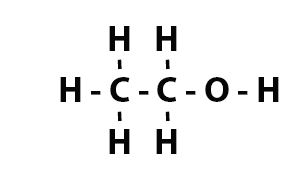
Với công thức hoá học của rượu C2H5OH:
Ngoài ra còn một số loại rượu khác như:
- Rượu isobutylic: C4H9OH
- Rượu propylic: CH3 – CH2 – CH2 – OH
- Rượu butylic: CH3 – CH2 – CH2 – CH2 – OH
- Rượu metylic hoặc methanol: CH3OH
- Rượu isopropylic: C3H7OH
- Rượu bezylic: C6H5CH2OH
Tính chất và công dụng của rượu hoá học
Tính chất vật lý
Với rượu Etylic hay ethanol thường có đặc điểm sau:
- Có mùi thơm nồng
- Vị cay
- Không màu (ở nhiệt độ thường)
- Chất lỏng
- Sôi ở 78.3oC
Tính chất hoá học
Với rượu Etylic hay ethanol thường có đặc điểm sau:
- Tác dụng với axit
- Có thể tác dụng với các kim loại mạnh như : Na , K…..
- Gây ra phản ứng cháy (O2)
Công dụng và ứng dụng của rượu
Rượu có rất nhiều công dụng trong cuộc sống cũng như trong phòng thí nghiệm:
- Dùng để sát khuẩn như cồn
- Giúp các sản phẩm chống đông lạnh
- Dùng làm xăng
Ngoài ra còn rất nhiều tác dụng khác của cồn, tuy nhiên khi sử dụng cần lưu ý về độ của rượu. Tuỳ thuộc vào mục đích sử dụng mà lấy một lượng rượu vừa phải. Vì trong rượu cũng có chất ảnh hưởng không tốt tới sức khoẻ con người. Nếu không sử dụng đúng mục đích nó sẽ làm phản tác dụng.
Phân biệt rượu uống và rượu hoá học
Rượu hoá học là loại rượu chưa qua pha chế.
Rượu uống là rượu đã được qua pha chế.
Điều chế rượu
Rượu thường được điều chế từ tinh bột hoặc đường lên men.
Với tinh bột cần qua những công đoạn sau:
Bước 1: Nấu chín ngũ cốc
Bước 2: Trộn men
Bước 3: Ủ khô
Bước 4: Ủ ướt
Bước 5: Chưng cất rượu
Bước 6: Xử lý khử độc tố cho rượu
Giải bài tập về công thức hoá học của rượu
Công thức tính độ rượu
Công thức điều chế rượu mà khi nhắc tới bài tập về rượu mọi người cần chú ý là:
Đr = (Vr/Vhh)*100
Trong đó:
- Đr là độ rượu (độ)
- Vr là thể tích rượu etylic (ml)
- Vhh là thể tích hỗn hợp rượu và nước (ml)
Bài tập có lời giải
Bài 1:
Hòa tan m gam ancol etylic ( D = 0,4 gam/ ml ) vào 108 ml nước ( D = 1 gam/ ml ), tạo thành dung dịch A. Cho A tác dụng với Na dư thu được 85.12 lít (đktc) khí H2. Dung dịch A có độ rượu bằng bao nhiêu?
Lời giải:
Ta có: Đr = (Vr/Vhh)*100
Phương trình phản ứng:
- Na + C2H5OH → C2H5ONa + 1/2H2
x → x x/2
- Na + H2O → NaOH + 1/2H2
y → y y/2
Ta có: nH2O = y và nH2 = 85.12 / 22.4 = 3.8 mol = x/2 + y/2
⇒ nC2H5OH = x = 3,2 mol
⇒ mC2H5OH = 1.9*46 = 87.4 gam
Vậy V = m/d = 87.4/0.4 = 218.5 ml
Vhh = 218.5 + 108 = 326.5 ml
⇒ D = 218.5.100/326.5 = 67 độ
Bài 2:
Biết khối lượng riêng của C2H5OH là 0,6 gam/ ml, khi đó khối lượng glucôzơ cần để điều chế 1 lít dung dịch rượu etylic 40 độ với hiệu suất 70% là bao nhiêu ?
Lời giải:
C6H12O6 → 2C2H5OH
Ta có: Đr = (Vr/Vhh)*100
⇒ V =0,3.1000 = 300 ml
⇒ mr = 300.0,6 = 180 gam
⇒ mglucôzơ = 180.180.100/(92.80) = 440.2 gam
Kết luận
Hy vọng qua bài viết trên mọi người có thể hiểu rõ về rượu. Nắm vững được công thức hoá học của rượu, ứng dụng và cách điều chế rượu sẽ rất hữu ích cho các bạn. Vì trong cuộc sống rượu là một chất được ứng dụng rất lớn.