Bạn đang học lớp 9, đang tìm kiếm công thức tính nồng độ đương lượng? Nội dung trong bài viết dưới đây sẽ giúp các em học sinh hiểu về nồng độ đương lượng, công thức và một số bài tập có lời giải chi tiết để các em luyện tập. Từ đó các em nhớ công thức được lâu hơn và dễ dàng giải những bài tập hóa học.
>>Xem thêm:
- Công thức tính độ tan
- Công thức tính nồng độ mol, nồng độ phần trăm dung dịch
- Công thức tính phần trăm khối lượng

Định nghĩa nồng độ đương lượng là gì?
Đương lượng hay còn có tên tiếng anh là Equivalent là đơn vị đo lường được sử dụng trong hóa học và sinh học. Áp dụng đương lượng để đo lường khả năng của một chất kết hợp với những chất khác. Hay đương lượng còn được áp dụng khi nói về nồng độ chuẩn.
Đương lượng của 1 nguyên tố chính là số phần khối lượng của nguyên tố đó kết hợp với 1,008 phần khối lượng của hidro hoặc là 8 phần khối lượng của oxy hoặc thay thế những lượng đó trong hợp chất.
Đương lượng gram của 1 chất là khối lượng của chất đó có thể thay thế hoặc phản ứng vừa đủ với 1 gram hydro
Đương lượng gram của một chất khong phải là 1 giá trị nhất định mà nó có thể thay đổi theo từng phản ứng cụ thể khác. Nồng độ đương lượng còn có tên gọi khác là nồng độ đương lượng gram
Ví dụ: đương lượng gram oxi là 4, vì nguyên tử khối của oxy là 8, và nó có hóa trị 2 trong các hợp chất. Đương lượng gram của hydro là 1 vì nguyên tử khối của hydro là 1 và có hóa trị 1 trong mọi hợp chất phổ biến
Tổng hợp công thức tính nồng độ đương lượng
Công thức tính nồng độ đương lượng gram
Công thức tính nồng độ đương lượng gram bằng khối lượng chia cho số mol
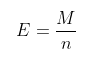
Trong đó: E là đương lượng gram
n chính là số mol
M chính là khối lượng
Cách xác định n số mol là:
- Nếu là axit thì n là số H+ có trong phân tử axit đó
- Nếu là bazo thì n là số nhóm OH– có trong phân tử bazo đó
- Nếu là muối thì n = tổng số hóa trị của các nguyên tử kim loại có trong muối
- Nếu là chất oxy hóa hoặc chất khử thì n là số electron nhận hoặc cho của chất đó
Công thức tính nồng độ đương lượng CN
Công thức tính nồng độ đương lượng của dung dịch N nào đó là:
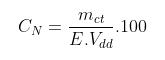
Trong đó mct là khối lượng chất tan nguyên chất (gram)
E là đương lượng gram của chất đó
CN là nồng độ đương lượng của dung dịch N nào đó
Vdd là thể tích dung dịch (ml)
Chú ý: Áp dụng quy tắc “tích số mol và hóa trị của các chất tham gia phản ứng là bằng nhau” để có thể tính được những bài toán hỗn hợp nhiều chất cùng loại phản ứng với nhau sẽ chuyển bài toán đó từ cao cấp phức tạp nhiều phản ứng theo thứ tự ưu tiên thành bài toán tối giản nhất.
Bài tập có lời giải về tính nồng độ đương lượng
Bài tập 1: Tính nồng độ đương lượng của dung dịch H2SO4 30%, biết d = 1,25g/ml
Lời giải:
Áp dụng công thức nồng độ đương lượng gram ta có:
EH2SO4 = 98 : 2 = 49
=) Nồng độ đương lượng của dung dịch H2SO4 là:
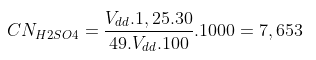
Bài tập 2: Hòa tan 5 mol HCL thành 20 lít dung dịch. Tính nồng độ đương lượng gram/lit của dung dịch?
Lời giải
Khối lượng 5 mol HCL là:
a = 5. MHCL
Nồng độ CN của dung dịch HCL là:
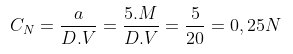
Hy vọng với định nghĩa, công thức và bài tập tính nồng độ đương lượng ở trên sẽ giúp các em giải nhanh những bài toán hóa học. Đặc biệt để tính toán nhanh những bài tập ôn luyện chuyên cho học sinh giỏi thì các em nhớ làm thật nhiều bài tập từ đơn giản đến nâng cao để vừa nhớ công thức lâu và khi nhìn vào đề bài có thể nhanh chóng hình dung ra cách giải nhé.







